2024台山一中高三第一次月考化学试题及答案解析
![]()
![]()
![]() 台山一中2024届高三第一次月考
台山一中2024届高三第一次月考
化学科试题 2023-08
说明:本次考试75分钟,共20道题,满分100分
可能用到的相对原子用量:H-1 C-12 N-14 O-16 Cl-35.5
一、选择题:本题共16小题,共44分。第1-10小题,每小题2分;第11-16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 文物记载着中华文明的灿烂成就,下列文物主要由合金材料制成的是 ( )
文物 |
|
|
|
|
选项 | A.圆雕玉舞人 | B.透雕重环玉佩 | C.朱雀青铜顶饰 | D.炫纹贯耳瓷壶 |
2.高分子材料在生产生活中应用广泛。下列说法错误的是
A.芦苇可用于制造黏胶纤维,其主要成分为纤维素
B.聚氯乙烯通过加聚反应制得,可用于制作不粘锅的耐热涂层
C.淀粉是相对分子质量可达几十万的天然高分子物质
D.大豆蛋白纤维是一种可降解材料
3.下列过程没有发生化学反应的是( )
A.用活性炭去除冰箱中的异味
B.用热碱水清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.用含硅胶、铁粉的透气小袋与食品一起密封包装
4.工业上由石英砂(主要成分为![]() )制备高纯硅的过程中涉及反应:
)制备高纯硅的过程中涉及反应:![]() ;
;![]() ,下列说法正确的是 ( )
,下列说法正确的是 ( )
A.![]() 的球棍模型为
的球棍模型为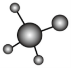 B.28g晶体硅中含有2molSi-Si键
B.28g晶体硅中含有2molSi-Si键
C.HCl中化学键为s-sσ键 D.碳的同素异形体金刚石和![]() 均属于共价晶体
均属于共价晶体
5.宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是 ( )
A.![]() 放入水中:
放入水中:![]()
B.![]() 通过灼热铁粉:
通过灼热铁粉:![]()
C.铜丝插入热的浓硫酸中:![]()
D.![]() 通入酸性
通入酸性![]() 溶液中:
溶液中:![]()
6.下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
| 物质(括号内为杂质) | 除杂试剂 |
A | FeCl2溶液(FeCl3) | Fe粉 |
B | Cl2(HCl) | H2O、浓H2SO4 |
C | NaCl溶液(MgCl2) | NaOH溶液、稀HCl |
D | NO(NO2) | H2O、无水CaCl2 |
7.对下列粒子组在溶液中能否大量共存的判断和分析均正确的是
| 粒子组 | 判断和分析 |
A |
| 不能大量共存,因发生反应 |
B |
| 不能大量共存,因发生反应:
|
C |
| 能大量共存,粒子间不反应 |
D | AlO2-、Na+、K+、HCO3- | 能大量共存,粒子间不反应 |
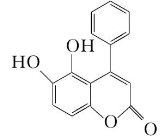 8.我国科技工作者发现某“小分子胶水”(结构如图)能助力自噬细胞“吞没”致病蛋白。
8.我国科技工作者发现某“小分子胶水”(结构如图)能助力自噬细胞“吞没”致病蛋白。
下列说法正确的是 ( )
A.该分子中所有碳原子一定共平面
B.1 mol该物质最多能与3 mol NaOH反应
C.该分子能与蛋白质分子形成氢键
D.该物质能发生取代、加成和消去反应
![]() 9.
9.![]() 常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为
常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为
6I2 +11KClO3 + 3H2O === 6KH(IO3)2 + 5KCl + 3Cl2↑。下列说法错误的是 ( )
A.产生22.4L(标准状况)![]() 时,反应中转移
时,反应中转移![]()
B.反应中氧化剂和还原剂的物质的量之比为11:6
C.可用石灰乳吸收反应产生的![]() 制备漂白粉
制备漂白粉
D.可用酸化的淀粉碘化钾溶液检验食盐中![]() 的存在
的存在
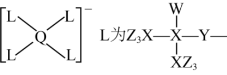 10. 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是 ( )
10. 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是 ( )
A. 第一电离能![]() B.W与X的化合物存在氢键
B.W与X的化合物存在氢键
C. Q的氧化物是两性氧化物 D. 该阴离子中含有配位键
11.芬顿法常用于废水的处理,反应为:NH4OCN+3H2O2= N2↑+ CO2↑+ 5H2O,设NA为阿伏伽德罗常数,下列有关说法不正确的是 ( )
A.H2O2 存在极性共价键和非极性共价键
B.18g H2O 中含有中子数目为 8NA
C.标准状况下,22.4L CO2 中含有σ键数目为 2NA
D.1mol NH4OCN 参与反应时转移电子数为 3NA
12.下列实验过程能达到实验目的的是 ( )
选项 | 实验目的 | 实验过程 |
A | 检验某铁的氧化物含二价铁 | 将该氧化物溶于浓盐酸,滴入KMnO4溶液,紫色褪去 |
B | 检验乙醇中含有水 | 用试管取少量的乙醇,加入一小块钠,产生无色气体 |
C | 证明酸性:H2SO3>HClO | 在Ca(ClO)2溶液中通入SO2气体,观察是否有沉淀生成 |
D | 证明CO2有氧化性 | 将点燃的镁条,迅速伸入盛满CO2的集气瓶中,产生大量白烟且瓶内有黑色颗粒产生 |
13. 陈述I和陈述Ⅱ均正确且具有因果关系的是 ( )
选项 | 陈述I | 陈述Ⅱ |
A | 用FeCl3溶液刻蚀铜质电路板 | 氧化性:Fe3+>Cu2+ |
B | 用Na2O2作呼吸面具的氧气来源 | Na2O2能氧化CO2 |
C | 用Na2S除去废水中的Cu2+和Hg2+ | Na2S具有还原性 |
D | 用石灰乳脱除烟气中的SO2 | SO2具有氧化性 |
14.电解废旧锂电池中的![]() 示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法正确的是 ( )
示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法正确的是 ( )
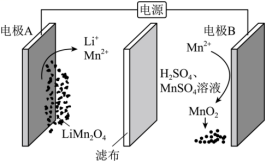
A.电极A的电极反应为:![]()
B.电极B为阳极,发生还原反应
C.电解结束,溶液的![]() 增大
增大
D.电解一段时间后溶液中![]() 浓度减小
浓度减小
15. 我国科技工作者利用计算机模拟N2在不同催化剂,以及硫酸作电解质溶液的条件下,电解还原制备氨气反应历程中相对吉布斯自由能变化如图所示(*代表微粒吸附在催化剂表面)。下列说法错误的是 ( )
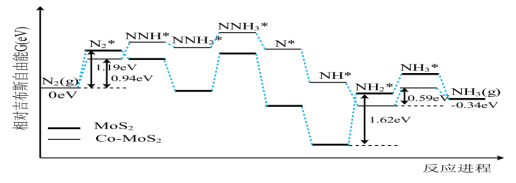
A. 该反应历程在阳极发生 B. 该反应历程实现了人工固氮
C. 从热力学趋势来说该反应能自发进行 D. 该历程的总反应为![]()
16.天然溶洞的形成与水体中含碳物种的浓度有密切关系。已知Ksp(CaCO3)=10-8.7,某溶洞水体中lgc(X)(X为![]() 、
、![]() 或Ca2+)与pH变化的关系如图所示。下列说法不正确的是 ( )
或Ca2+)与pH变化的关系如图所示。下列说法不正确的是 ( )
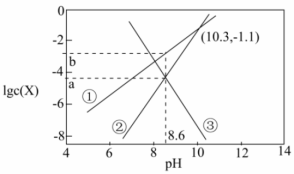
A.曲线①代表HCO![]() ,曲线③代表Ca2+ B.a=-4.35,b=-2.65
,曲线③代表Ca2+ B.a=-4.35,b=-2.65
C.由图中的数据计算得Ka2(H2CO3)=10-10.3 D.pH=10.3时,c(Ca2+)=10-6.5mol•L-1
二、非选择题:本题共4小题,共56分。
17.按要求填空(14分)
(1)①基态镓(Ga)原子的核外电子排布式为_________________________________
②SO3分子VSEPR_______________
(2)向新制Cu(OH)2的悬浊液滴加少量乙醛,并加热,写出其反应化学方程式:__________________
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:
(4)将ClO2通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成,写出二氧化氯与硫化氢溶液反应的离子方程式:
(5)H3PO2是一元中强酸,H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
(6)联氨(N2H4)是一种常用的还原剂。其氧化产物一般为N2。联氨可用于处理高压锅炉水中溶解的氧,防止锅炉被腐蚀。理论上1.0 kg的联氨可除去水中溶解的O2___________kg。
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为_____________。(计算结果保留两位小数)
18(14分).某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是_____________________________________________。
②电极反应式:
ⅰ.氧化反应:2Cl--2e-===Cl2↑
ⅱ.还原反应:______________________________________。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
ⅰ.随c(Cl-)降低,Cl-还原性减弱或Cl2的氧化性增强。
ⅱ.随c(H+)降低或c(Mn2+)浓度升高,_____________________。
④补充实验证实了③中的分析(下面表格)。
a是 ,b是 。
| 实验操作 | 试剂 | 产物 |
Ⅰ |
| 较浓H2SO4 | 有氯气 |
Ⅱ | a | 有氯气 | |
Ⅲ | a+b | 无氯气 |
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是 。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是 。
(4)综合上述,可以得到物质氧化性和还原性变化的一般规律:
氧化剂(还原剂)的浓度越大,其氧化性(还原性)越强;还原产物(氧化产物)的浓度越大,氧化剂(还原剂)的氧化性(还原性)越小
据此,小组分别利用电解池(图1)和原电池(图2)装置,成功实现了铜与稀硫酸制氢气。
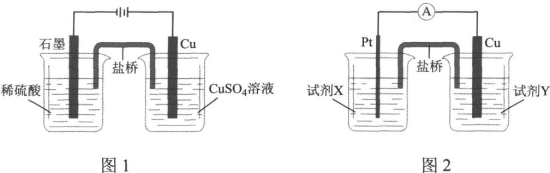
结合上述的探究结论,图2中试剂X是 ,试剂Y是 。(限选试剂:稀硫酸、Na2SO4溶液、NaOH溶液、NaNO3溶液、CuSO4溶液,浓度均为1.0 mol·L-1)
19.(14分)锗(Ge)是门捷列夫在1871年所预言的元素“亚硅”,高纯度的锗已成为目前重要的半导体材料,其化合物在治疗癌症方面也有着独特的功效。下图是以锗锌矿(主要成分为![]() 、ZnS,另外含有少量的
、ZnS,另外含有少量的![]() 等)为主要原料生产高纯度锗的工艺流程:
等)为主要原料生产高纯度锗的工艺流程:
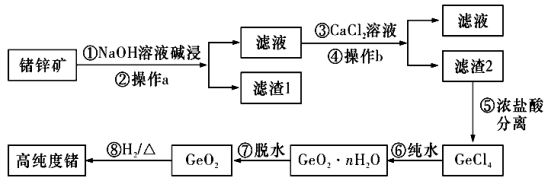
已知:![]() 可溶于强碱溶液,生成锗酸盐。
可溶于强碱溶液,生成锗酸盐。![]() 的熔点为
的熔点为![]() ℃,沸点为84℃,在水中或酸的稀溶液中易水解。
℃,沸点为84℃,在水中或酸的稀溶液中易水解。
(1)Ge位于ⅣA族,属于_________区,![]() 晶体所属类别是______________。
晶体所属类别是______________。
(2)步骤①NaOH溶液碱浸时发生的离子反应方程式为____________________________。
(3)步骤③沉锗过程中,当温度为90℃,pH为14时,加料量(![]() 质量比)对沉锗的影响如表所示,选择最佳加料量为____________(填“10-15”“15-20”或“20-25”)。
质量比)对沉锗的影响如表所示,选择最佳加料量为____________(填“10-15”“15-20”或“20-25”)。
编号 | 加料量( | 母液体积 (mL) | 过滤后滤液含锗(mg/L) | 过滤后滤液pH | 锗沉淀率 (%) |
1 | 10 | 500 | 76 | 8 | 93.67 |
2 | 15 | 500 | 20 | 8 | 98.15 |
3 | 20 | 500 | 2 | 11 | 99.78 |
4 | 25 | 500 | 1.5 | 12 | 99.85 |
(4)步骤⑤中选择浓盐酸而不选择稀盐酸的原因是________________________________。
(5)步骤⑥的化学反应方程式为________________________________________________。
(6)Ge元素的单质及其化合物都具有独特的优异性能.请回答下列问题:
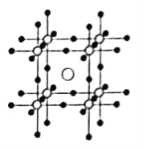
①量子化学计算显示含锗化合物![]() 具有良好的光电化学性能。
具有良好的光电化学性能。![]() 是
是![]() 的量子化学计算模型,
的量子化学计算模型,![]() 的晶体结构如图所示,若设定图中体心钙离子的分数坐标为
的晶体结构如图所示,若设定图中体心钙离子的分数坐标为![]() ,则分数坐标为
,则分数坐标为![]() 的离子是__________。
的离子是__________。
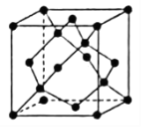
②晶体Ge是优良的半导体,可作高频率电流的检波和交流电的整流用。如图为Ge单晶的晶胞,设Ge原子半径为r pm,其中晶胞体对角线长度为8r pm,阿伏加德罗常数的值为![]() ,则该锗晶体的密度计算式为(不需化简)
,则该锗晶体的密度计算式为(不需化简)![]() ______________________
______________________![]() 。(已知相对原子量:Ge 73)
。(已知相对原子量:Ge 73)
20.(14分)
丹参酮系列化合物是中药丹参的主要活性成分,具有抗菌消炎、活血化瘀、促进伤口愈合等多种作用,其衍生物J的合成路线如下:
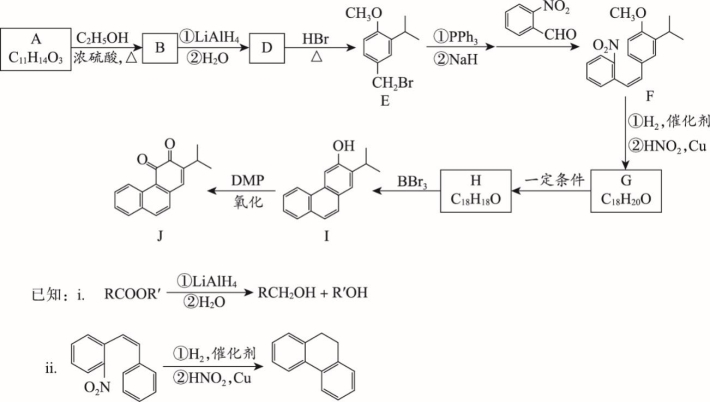
(1)E中含有的官能团名称:________________。
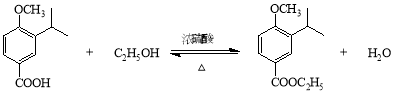
(2)A→B的化学方程式为____________________________________________________。
(3)D→E的反应类型为___________________。
(4)下列关于化合物B、D的说法正确的是_______(填字母序号)。
a.D含有手性碳原子
b.B和D均能使酸性KMnO4溶液褪色
c.B和D在水中的溶解性:B > D
d.B的一种同分异构体含有苯环和碳碳双键,且1 mol该异构体能与3 mol NaOH反应
(5)由F制备G的反应中,同时会生成一种副产物G’,它与G互为同分异构体,G’的结构简式为________________。
(6)已知I→J反应过程中1 mol DMP可得2 mol电子,则反应中I与DMP的物质的量之比为______。
(7)丹参酮IIA的合成过程中有如下转化,已知X含三种官能团,不与金属Na反应放出H2,丹参酮IIA分子中所有与氧原子连接的碳均为sp2杂化。
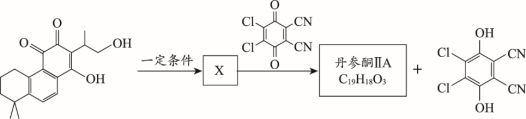
写出X的分子式:___________;丹参酮IIA的结构简式:_________________。
台山一中2024届高三第一次月考化学
参***
1-5:CBABD 6-10:CBCAB 11-16:DDACAD
17(14分,除有说明外,每空2分).
![]() (1)①1s22s22p63s23p63d104s24p1 1分 ②平面三角形 1分
(1)①1s22s22p63s23p63d104s24p1 1分 ②平面三角形 1分
(2)CH3CHO+2Cu(OH)2+NaOH →CH3COONa+Cu2O↓+3H2O 2分
(3)2Fe(OH)3+3ClO-+4OH-===2FeO42-+5H2O+3Cl- 2分
(4) 5H2S +8ClO2 +4H2O === 18H+ +5SO42- +8Cl- 2分
(5)H3PO4 (6)1.0 2分 (7) 2.63 2分
![]() 18.(14分,除有说明外,每空2分)
18.(14分,除有说明外,每空2分)
(1)①MnO2+4H++2Cl-===Mn2++Cl2↑+2H2O 2分
②MnO2+2e-+4H+===Mn2++2H2O 2分 ③MnO2氧化性减弱(1分)
④KCl固体(或浓/饱和溶液)(1分) MnSO4固体(或浓/饱和溶液)(1分)
(2)KCl>KBr>KI 2分(3)AgNO3或Ag2SO4 2分
(4)稀硫酸(1分) 、NaOH溶液 2分
19.(14分,除标注外每空2分)
(1) P (1分) 分子晶体 (1分)
(2)GeO2 +2OH-![]() GeO32- +H2O (3) 20-25
GeO32- +H2O (3) 20-25
(4) GeCl4在稀盐酸小易水解 (5)GeCl4+(2+n)H2O![]() GeO2·nH2O↓+4HCl
GeO2·nH2O↓+4HCl
(6)①I- ②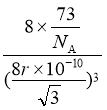
20.(14分)
(1)醚键、碳溴键 (2分)
(2) (2分)
(2分)
(3)取代反应 (1分)
(4)bd (2分)
(5) 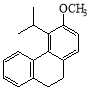 (2分)
(2分)
(6)1∶2 (2分)
(7) C19H20O3 (1分)
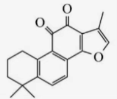 (2分)
(2分)
![]()
![]()